《食品科学》:云南农业大学黄艾祥教授等:发酵粘液乳杆菌信号分子AI-2合成蛋白S-核糖同型半胱氨酸酶的结构和功能特性分析
食品科学杂志
微生物间并不是独立存在、互不相干的,微生物间的交流普遍存在,微生物通过群体感应(QS)系统进行种间及种内的交流。自诱导物2(AI-2)介导的S-核糖同型半胱氨酸酶(LuxS)/AI-2型QS系统是乳酸菌中的主要QS系统,该系统已被证明参与调控乳酸菌生物膜、细菌素、苯乳酸、共轭亚油酸和胞外多糖等功能因子的合成,能够提升菌株的抗逆性、黏附性和抗菌特性。信号分子AI-2被称为“细菌的世界语”,是LuxS/AI-2型QS的关键元件,是由LuxS催化而成的呋喃酮类似物。
蛋白结构和功能鉴别对于理解其生物学功能具有重要意义。LuxS属于小型金属蛋白酶,参与细菌的多种生理调节。特别地,LuxS作为LuxS/AI-2型QS系统中的关键调控蛋白,作用于S-核糖同型半胱氨酸(SRH)生成信号分子AI-2的前体物质4,5-羟基-2,3-戊二酮(DPD),DPD再通过重排及一系列的附加反应生成AI-2,从而激活细菌的QS系统。研究表明,敲除或过表达编码LuxS合成的luxS基因均能显著影响乳酸菌生物膜、细菌素和胞外多糖的产量,以及影响菌株的耐酸性、抗氧化应激能力及耐胆盐性等,因此LuxS介导的AI-2型QS(LuxS/AI-2)在乳酸菌功能因子形成及生理调控中发挥着重要的作用。
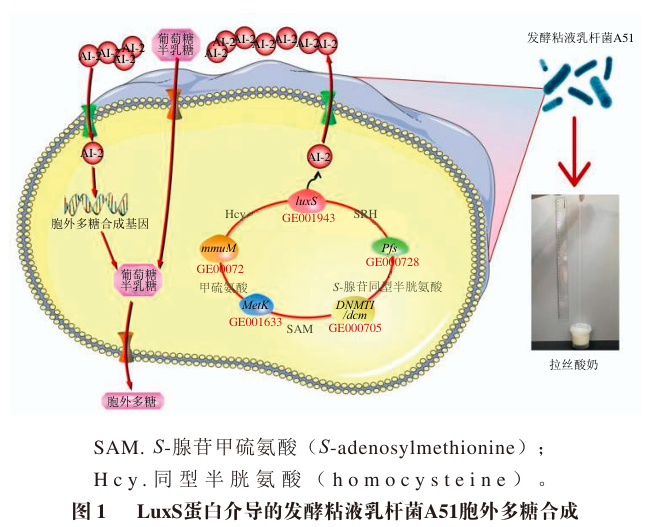
云南农业大学食品科学技术学院的魏光强、王藤和黄艾祥*等人的课题组前期从香格里拉自然发酵牦牛奶中优选了高产胞外多糖的发酵粘液乳杆菌A51(Limosilactobacillus fermentum A51),该分泌的胞外多糖具有黏稠的物理特性,是改善酸奶质构特性和营养功能的关键功能因子。进一步研究发现,发酵粘液乳杆菌A51具有调控信号分子AI-2合成的luxS基因和LuxS,且LuxS正向调控信号分子AI-2和胞外多糖的合成(图1)。为了进一步了解发酵粘液乳杆菌A51信号分子AI-2合成蛋白LuxS的结构特征和功能特性,研究通过多重生物信息学分析LuxS的理化性质、亲疏水性、信号肽、跨膜结构域、磷酸化位点、结构域以及空间结构,并结合蛋白互作网络,探究LuxS蛋白的结构和功能特性,以期为深入研究LuxS调控乳酸菌AI-2型QS系统及功能因子的合成提供理论基础。
1LuxS的多序列比对和进化关系分析
利用NCBI数据库收集与发酵粘液乳杆菌A51的LuxS同源性较高菌株的LuxS氨基酸序列进行多序列比对。由图2可知,信号分子AI-2合成蛋白LuxS的氨基酸序列与粘液乳杆菌、罗伊氏粘液乳杆菌、酒窖片球菌和嗜酸乳杆菌等菌株具有较高的同源性;特别地,LuxS氨基酸序列与发酵粘液乳杆菌(GenBank序列号:WP 003681394.1)的LuxS同源性高达100%。

根据LuxS氨基酸序列的同源性分析结果,使用MEGA 11软件构建LuxS的系统进化树。由图3可知,LuxS与来源于发酵粘液乳杆菌(GenBank序列号:WP 003681394.1)的LuxS位于同一进化分支,其置信度高达100,表明LuxS的氨基酸序列在相同物种中具有较高的保守性,亲缘关系较近。而不同物种之间的LuxS氨基酸序列相似性较低,亲缘关系较远,这为物种间的分类提供了重要信息。

2LuxS的理化性质分析

3LuxS的亲疏水区域、信号肽及蛋白质跨膜域分析
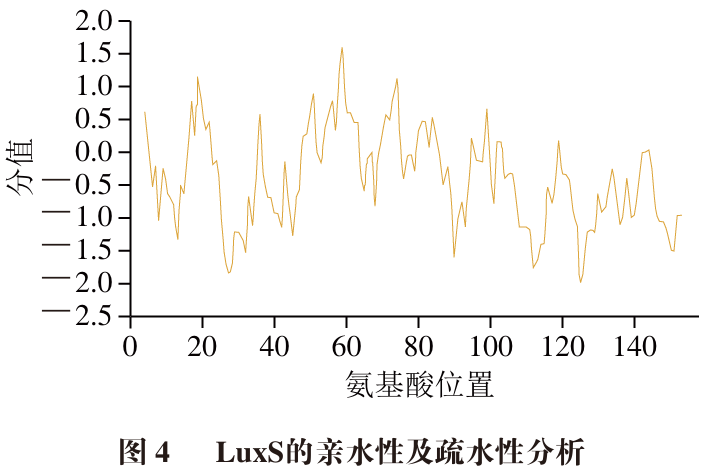
蛋白质结构的稳定在很大程度上取决于分子间亲/疏水性的平衡,蛋白质中疏水氨基酸的疏水基团不仅可以促使蛋白质二级结构的折叠,还有利于蛋白形成α-螺旋,提升其稳定性,同时疏水性推动了蛋白质折叠成复杂的高级结构,从而发挥复杂的生物化学功能。采用ProtScale工具对LuxS进行亲/疏水性预测,确定最大亲/疏水值及其相对应的氨基酸残基位置。
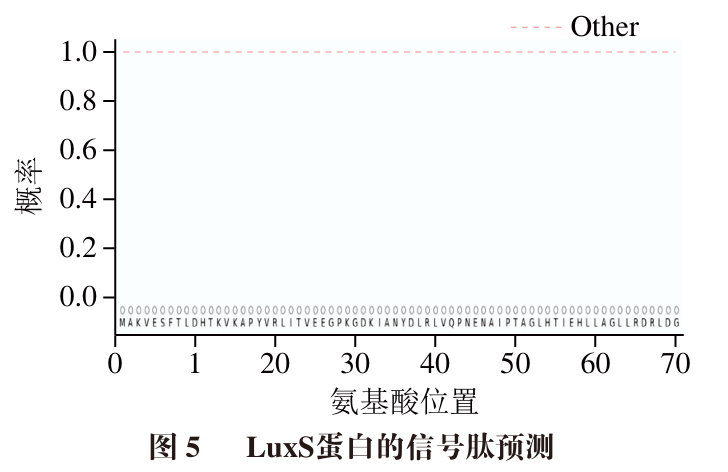
信号肽是蛋白质N末端一段编码长度为5~30的疏水性氨基酸编码序列,存在于外分泌蛋白和真核生物细胞器内的蛋白中,在引导和转运跨膜蛋白以及分泌蛋白方面发挥着重要作用。由图5可知,预测LuxS蛋白存在信号肽的概率为0.000 5,而且不含信号肽序列及信号肽切割位点,说明LuxS为内分泌型蛋白,该蛋白主要在细胞内发挥作用,在细胞外环境分泌较少,信号肽含量过低,故未观察到信号肽区域,这与LuxS的亲/疏水性分析结果一致,LuxS的N末端并没有一段编码长度为5~30的疏水性氨基酸序列,因此该蛋白没有信号肽。
蛋白质跨膜域指的是蛋白质序列中跨越细胞膜的区域,该跨膜域为α-螺旋结构,约由20~25 个氨基酸残基组成,构成跨膜域蛋白的氨基酸大部分为疏水性氨基酸。采用在线分析工具TMHMM Sever v. 2.0对LuxS进行跨膜区域预测。如图6所示,LuxS蛋白为胞内蛋白,无跨膜结构,即没有介导物质运输及信号传递等功能,主要在胞内发挥作用,与信号肽分析结果一致。综合信号肽及蛋白质跨膜域分析,确定LuxS为内分泌型胞内蛋白,无法分泌到胞外,主要在胞内发挥功能作用。LuxS已被证明参与调控乳酸菌胞内信号分子AI-2的合成,该蛋白通过将SRH转化为Hcy,同时生成AI-2的前体物质DPD,DPD通过重排及一系列的附加反应生成AI-2,表明LuxS是调控发酵粘液乳杆菌A51信号分子AI-2合成的关键蛋白。合成的AI-2通过转运蛋白转运到胞外,当胞外AI-2的浓度达到一定的阈值时,其被受体蛋白识别并内化到胞内调控胞外多糖合成相关基因的表达,从而调控胞外多糖的合成。
4LuxS的磷酸化位点和糖基化位点
蛋白质翻译后修饰通过功能基团或蛋白质的共价添加、调节亚基的蛋白水解切割或整个蛋白质的降解增加蛋白质组的功能多样性。这些修饰包括磷酸化、糖基化、泛素化、亚硝基化、甲基化、乙酰化和脂质化等,几乎影响正常细胞生物学的所有方面。蛋白质磷酸化是通过酶促反应将磷酸基团转移到蛋白组氨基酸残基上的过程,主要发生在丝氨酸、苏氨酸或酪氨酸残基上,磷酸化在细胞周期、生长、凋亡和信号转导等过程中起着重要的调控作用。蛋白质糖基化是指在糖基转移酶作用下将糖转移至蛋白质和蛋白质上的氨基酸残基形成糖苷键的过程,主要发生在赖氨酸和精氨酸残基上,蛋白质糖基化对蛋白质的折叠、构象、分布、稳定性和活性都有重要影响。
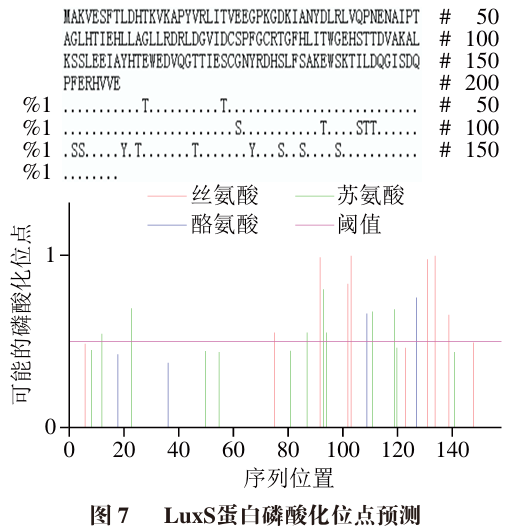
通过NetPhos 3.1 Server在线分析LuxS蛋白的磷酸化位点,结果如图7所示。LuxS共有16 个超过阈值的磷酸化位点,无超过阈值的糖基化位点。16 个磷酸化位点主要分布在第90~140位氨基酸残基之间,说明后端碱基可能是蛋白质进行修饰的主要部分。16 个超过阈值的磷酸化位点包括丝氨酸(Ser)位点7 个、苏氨酸(Thr)位点7 个、酪氨酸(Tyr)位点2 个,这与Ramazi等的研究结果相似。在许多细菌中,LuxS中酪氨酸的磷酸化与胞外多糖的产生有关。推测发酵粘液乳杆菌A51胞内LuxS的Y109、Y127位点发生磷酸化修饰能正向调控QS系统信号分子AI-2的产生,产生的AI-2激活LuxS/AI-2型QS,从而调控胞外多糖的合成。研究表明,嗜水气单胞菌LuxS的K23和K30位点发生琥珀酰化修饰能正向调控信号分子AI-2的产生,激活菌体的活化甲基循环,促进信号分子AI-2的合成,区别于发酵粘液乳杆菌A51。综上,LuxS修饰在乳酸菌细胞生理调控中发挥着关键作用,然而LuxS的翻译后修饰(如磷酸化)对蛋白质结构和功能活性的影响及其调控AI-2的产生机制尚不明确,应该深入揭示LuxS翻译后修饰的调控机制及生理学意义。
5LuxS的亚细胞定位及功能域分析
PSORTII在线预测结果显示,LuxS蛋白主要定位在细胞质(56.5%),其次可能为细胞核(30.4%),小概率分布在细胞骨架、分析细胞小泡和线粒体,概率分别为4.3%、4.3%和4.3%,说明LuxS最有可能是细胞质蛋白,主要在细胞内发挥作用,与信号肽和蛋白质跨膜域分析结果一致。如图8所示,通过Conserved Domain数据库分析可知LuxS蛋白为单域结构,属于LuxS超级家族,含有1 个PRK02260结构域,该结构域的功能是调控乳酸菌信号分子AI-2的合成,从而激活乳酸菌的LuxS/AI-2型QS系统,进而调控菌株生理功能。
6LuxS蛋白的二级结构和空间结构
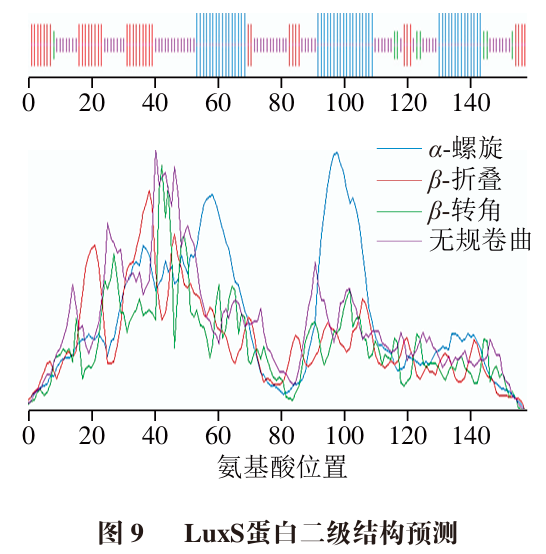
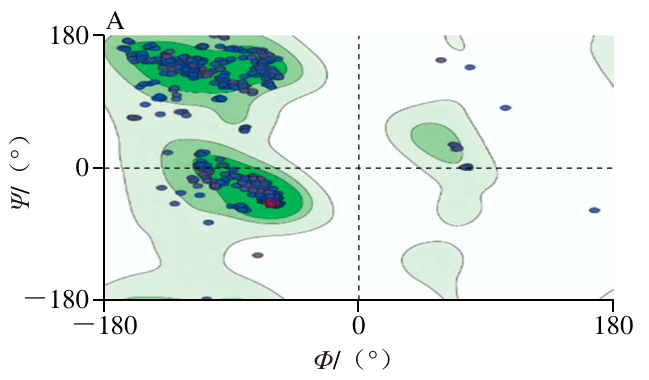
如图9所示,LuxS的二级结构由39.87%的无规卷曲、31.65%的α-螺旋、23.42%的β-折叠和5%的β-转角组成,无规卷曲和α-螺旋是LuxS的主要二级结构,与已知的LuxS二级结构含量组成相似。蛋白质的功能作用与其空间结构密切相关,二级结构中的α-螺旋可以稳定蛋白质骨架,且α-螺旋占比高的蛋白多为保守蛋白,这解释了LuxS蛋白具有极高保守性的原因。而无规卷曲则是蛋白质重要的功能区域,可使空间结构中的自由能达到最大从而促进蛋白质结构稳定。
通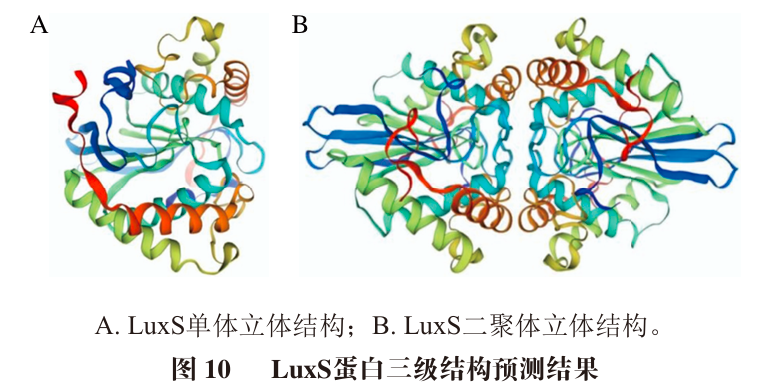

7LuxS的蛋白互作网络分析
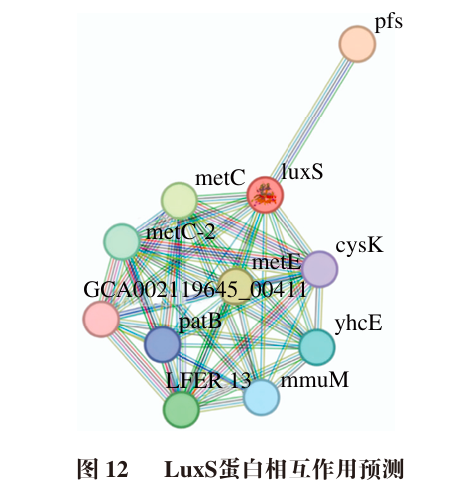
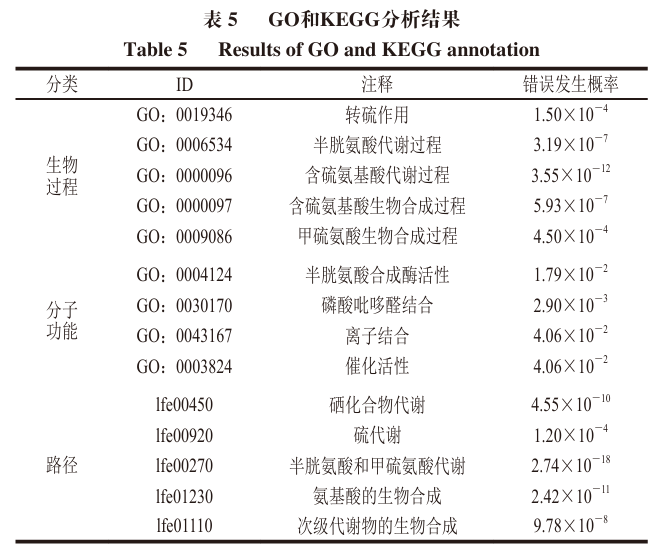
通过STRING数据库对LuxS进行蛋白质-蛋白质相互作用(PPI)网络构建,以获取其潜在蛋白质的交互作用,结果如图12和表4、5所示。LuxS的聚类系数为0.982;PPI富集P值为5.55×10-16;LuxS可能与pfs、metE、metC、LFER_1308、metC-2、yhcE、mmuM、patB、cysK和GCA_002119645_00411共10 个蛋白相互作用。LuxS的互作蛋白GO富集分析结果表明,互作蛋白主要参与的生物过程包括半胱氨酸代谢过程、含硫氨基酸代谢过程、含硫氨基酸生物合成过程和甲硫氨酸生物合成过程,主要参与的分子功能有半胱氨酸合成酶活性、离子结合和催化活性等(表5)。京都基因与基因组百科全书(KEGG)通路富集分析结果表明,LuxS主要参与的反应途径有半胱氨酸和甲硫氨酸代谢、氨基酸的生物合成以及次级代谢物的生物合成等,表明LuxS在菌株物质代谢合成等过程中发挥潜在生物学功能。已知LuxS的主要功能是参与活化甲基循环,从而合成QS系统中的信号分子AI-2,其具体合成路径:SAM通过甲基基团转移生成具有毒性的S-腺苷同型半胱氨酸,然后在甲硫腺苷核苷酶(由Pfs基因调控表达)作用下生产SRH,再经LuxS作用生产Hcy和AI-2的前体物质DPD,生成的Hcy又在酶的作用下生成SAM,最终实现活化甲基循环,从而激活菌株的半胱氨酸、甲硫氨酸代谢和合成途径。LuxS的蛋白互作网络为深入探讨其调控乳酸菌生理学特性及高产功能因子的分子机制提供了可靠的线索。

结 论
本研究通过多重生物信息学分析,全面解析了乳酸菌信号分子AI-2合成蛋白LuxS的结构特征和功能特性。LuxS蛋白是一种由158 个氨基酸编码且具有高度保守性和稳定性的酸性蛋白,分子质量为17 718.91 Da,理论等电点为5.29,无信号肽及跨膜结构域;存在16 个磷酸化位点,属LuxS超级家族。LuxS蛋白二级结构以无规卷曲和α-螺旋结构为主,三维结构被折叠成棒球状结构,且LuxS需要形成二聚体才能发挥活性。LuxS与pfs等10 个蛋白存在相互作用关系,这些互作蛋白主要参与半胱氨酸、蛋氨酸以及含硫氨基酸的代谢及合成,表明LuxS参与活化甲基循环从而调控菌株的QS系统和功能物质的代谢和合成。本研究对发酵粘液乳杆菌A51的信号分子AI-2合成蛋白LuxS结构特征和功能特性进行深入分析,可为进一步研究LuxS调控乳酸菌AI-2型QS系统提供理论基础。


云南农业大学食品科学技术学院,二级教授、博士生导师,云岭学者,首批云岭产业技术领军人才。兼任中国奶业协会常务理事,云南省奶业协会会长、云南省现代农业奶牛产业技术体系乳品加工与质量安全岗位专家、云南省科技项目专家。
学习经历:
1982.09—1986.07,云南农业大学动物生产、动物科学专业农学学士;
1986.09—1988.07,云南农业大学畜牧学专业农学硕士;
2003.09—2006.06,西南大学农产品加工及贮藏工程专业工学博士。
工作经历:
1988.07—1992.09,云南农业大学动物科学技术学院助教;
1992.09—1999.08,云南农业大学动物科学技术学院讲师;
1999.08—2008.11,云南农业大学食品科学技术学院副教授;
2008.11-至今,云南农业大学食品科学技术学院教授。
科研工作围绕高原特色现代肉乳产业和云南省3815战略目标,针对云南省畜产品加工技术瓶颈和转型升级科技需求,主持国家自科基金4 项、国家重点研发计划子课题及省重大科技专项、重点研发计划等10余项,开展了凝乳酶构效关系、凝乳机理、乳酸菌资源挖掘及特色畜产品特征品质形成机理研究,创新了乳饼、乳扇、奶酪、奶渣、功能发酵乳及火腿、牛干巴、冷鲜肉等绿色加工技术。先后获授权专利50 项,其中发明专利20 项;发表论文260 篇,其中SCI论文50 篇(1区TOP期刊40 篇)、EI 20 篇;研发30余项云南特色畜产品推广应用于云南省10余家畜产品龙头企业,研发乳饼成型机、解决了火腿牛干巴等只能冬季腌制等技术瓶颈、突破了家畜屠宰“两段式冷却”工艺及创新了水牛奶干酪和牦牛奶渣干酪素生产技术等,获云南省科技进步奖二等奖2项、三等奖2 项、中国食品科学技术学会自然科学二等奖1 项(均排名第1)。