水牛奶干酪功能活性肽的研究
王钰潭,侯坤辉,王雪峰,赵存朝,黄艾祥
云南农业大学,食品科学技术学院,(昆明 650201)
摘 要:以水牛奶为原料,研制不同凝乳酶的水牛奶干酪,利用单因素试验、二次通用旋转筛选奶酪蛋白肽提取工艺,并研究蛋白肽的抗氧化及抑菌功能活性。结果表明,水牛奶奶酪蛋白肽最佳提取工艺为料液比26:1、匀浆时间5min、转速10 rpm*1000;4种水牛奶奶酪蛋白肽均具有较好功能活性,其中贯筋藤凝乳酶奶酪的ABTS清除活性为82.22%±2.41%、还原能力(RP)为52.63%±2.63%、DPPH自由基清除能力为51.72%±2.35%,对李斯特菌抑菌率达到86.33%、沙门氏菌抑菌率达到55.36%。水牛奶干酪具有较丰富的功能活性物质,开发前景好。
关键词:水牛奶干酪;贯筋藤凝乳酶;活性肽;抗氧化;抑菌
Study on BuffaLo milk Cheese’s Functional Peptides
WANG Yutan,WANG Xuefeng,HOU Kunhui,ZHAO Cunchao,HUANG Aixiang
College of food science and technology, yunnan agricultural university, (kunming 650201)
Abstract:Using buffalo milk as raw material, the milk mash cheese with different rennet was developed. The single factor test and the second universal rotation were used to screen the cheese protein peptide extraction process, and the antioxidant and antibacterial activity of the protein peptide was studied. The results showed that the optimal extraction process of buffalo cheese protein peptide was as follows: the ratio of material to liquid was 26:1, the homogenization time was 5 min, and the rotation speed was 10 rpm*1000. The four kinds of buffalo milk protein peptides all had good functional activity. The ABTS scavenging activity of lactase cheese was 82.22%±2.41%, the reducing ability (RP) was 52.63%±2.63%, the DPPH free radical scavenging ability was 51.72%±2.35%, the inhibition rate against Listeria was 86.33%, and the Salmonella bacteriostatic rate was It reached 55.36%.Buffalo milk cheese has a rich functional active substance and has a good development prospect.
Key words:BuffaLo milk cheese; agglutinin;active peptide;antioxidation;bacteriostasis
我国西南部地区拥有着丰富的水牛奶资源,水牛奶乳汁浓郁,味道醇香甜美,乳脂肪、乳蛋白、乳糖、常量矿物元素和维生素等的营养成分上要优于其他奶源,是老少皆宜、不可多得的营养佳品[1,2]。乳制品中蛋白肽的开发研究是当代国际科学界和食品界最热门的研究课题和极具发展前景的功能营养成分,关于其相关的研究对于蛋白肽的运用于后期投入生产有着重大的奠定作用与指导作用,以此促进经济发展、造福人类健康[3,4,5]。贯筋藤(Dregea sinensis hemsL)为萝藦科、南山藤属植物,攀援木、质藤本,俗称“奶浆藤”。分布在中国大陆的云南、陕西、四川、贵州、甘肃等地,在大理、丽江地区[6]。贯筋藤蛋白酶是基于贯筋藤作为原材料提取而制成的一种天然植物凝乳剂,研究表明,其酶活性高,稳定性好,是一种新型优良的凝乳剂[7,8]。试验在现有研究的基础上,优化了前人的加工工艺,对比在不同凝乳剂的添加以及市场两种水牛奶奶酪产品的奶酪蛋白肽各项指标活性差异,为以后开展水牛奶奶酪乳蛋白肽新的研究,提供数据基础和理论依据。
1材料与方法
1.1材料
水牛奶:于德宏州芒市畜牧站水牛奶牛合作社提供;
发酵剂:FVV-221冷冻直投式干燥发酵剂,荷兰皇家帝斯曼公司;
凝乳剂:贯筋藤蛋白酶(GJTR)由本实验室提取,商业木瓜蛋白酶(食品级);
对照组:分别来自云南皇氏来思尔乳业有限公司和腾冲艾爱乳业公司市场销售的水牛奶干酪。
1.2主要仪器与设备
HI99161pH计(意大利哈纳仪器有限公司);UV-6100S紫外可见光分光光度仪(上海元析仪器有限公司);CT15RE高速冷冻离心机(日本电子株式会社);T25高性能分散机(德国IKA集团);HYP-1008消化炉(上海纤检仪器有限公司);GMSX-280压力蒸汽灭菌器(北京永光明医疗仪器有限公司);Scientz-500超声波清洗机(宁波新芝生物科技有限公司);GF254硅胶(德国MN公司);BLD1-10恒温搅拌器(常州华奥仪器有限公司)。
窗体顶端
1.3方法
1.3.1水牛奶奶酪工艺流程
水牛奶→均质→巴氏杀菌(65°C,30min)→接种发酵剂(0.03%,40°C,pH下降0.5左右)→加入凝乳酶搅(0.004%,45°C)→凝乳切割→排乳清堆酿(10min)→热烫拉伸(85℃-90℃)→成品
1.3.2蛋白肽提取工艺设计
干酪样品切碎→称取碎块→根据设定好的料液比加入蒸馏水→均质分离→高速冷冻离心(离心力为9000G、温度4℃、离心时间为20min)→取上清液→超滤(0.3Mpa,5K的超滤膜)→冷冻干燥(5-10 MPa,-50℃) →干酪蛋白肽
1.3.3蛋白肽提取单因素试验
以干酪上清液肽得率为活性肽提取单因素指标,对料液质量比(1:5、1:10、1:15、1:20、1:25、1:30)、匀浆时间(2、4、6、8和10min)、转速(9、11、13、15和17rpm×1000/min)三个因素做单因素实验,研究各因素变量对干酪上清液肽得率的影响。每组做3个重复。
1.3.4肽得率的测定多肽含量测定参考徐娟[9,10]等人的方法,略作修改进行测定。取2.5 mL样品溶液(取2.5 mL蒸馏水做调零组),加入2.5 mL10% (w/v)的三氯乙酸(TCA)水溶液混合均匀,静置 20 min,然后在3500 r/min、温度为4℃的高速离心机下离心10 min。然后取1.0 mL上述溶液置一试管中,加入双缩脲试剂3.0 m L(样液∶双缩脲试剂 =3∶2,体积比),用漩涡混合仪上混合均匀,60℃水浴显色5 min,2000 r/min、温度为4℃的高速离心机下离心10 min[11]。取上清液于310 nm下测定OD 值,稍后利用谷光甘肽(GSH)作为标准品,参考样品中多肽测定绘制标准曲线[12]:y=4.4062x-0.1449,R²=0.9978。
1.3.5二次通用旋转实验设计
在单因素试验的基础上,选择料液质量比、匀浆时间、转速3个因素,采用二次通用旋转试验设计,进行3因素5水平试验,试验因素水平见下表1。表1 二次通用旋转因素水平表
水平
因素
X1(温度/℃)
X2[液料比(mL/g)]
X3(时间/min)
+1.682
33.40
9.36
14.36
+1
30
8
13
0
25
6
11
-1
20
4
9
-1.682
16.59
2.64
7.64
1.3.6超滤操作步骤
根据陈东平[13,14]等人在《对于不同分子量酪蛋白肽对自由基清除作用》的一文研究中发现分子量越小的肽其自由基清除作用越强,活性越高。本文设置了针对5K以下的酪蛋白肽的提取与检测,操作步骤如下:
干酪样品切碎→称取碎块→根据设定好的料液比加入蒸馏水→均质分离→高速冷冻离心(离心力为9000G、温度4℃、离心时间为20min)→取上清液→超滤(0.3Mpa,5K的超滤膜)→冷冻干燥(5-10 MPa,-50℃) →干酪蛋白肽。
1.3.7蛋白肽的活性测定
1.3.7.1抗氧化活性测定
总抗氧化能力测定(TEAC)
参考Mahta Mirzaei等人的方法测定ABTS自由基清除能力[15.16]。吸取分子量5K以下的水牛奶干酪蛋白肽溶液500μL,加入734nm处吸光度为0.7 ~0.8 的ABTS•+稀释工作液(5mM pH 7.4的PBS稀释)3.8 mL,室温下反应6min,于734nm测定吸光值。总抗氧化能力用ABTS自由基清除率表示,计算采用如下公式[17]:ABTS•自由基清除率(%)=[(s-sb)/(c-cb)]×100%
式中:s——ABTS•自由基清除能力吸光度,sb——样品干扰试验吸光度(调零),c——ABTS•工作液吸光度,cb——蒸馏水吸光度(调零)。还原能力测定(RP)
吸取分子量5K以下的水牛奶干酪蛋白肽溶液加入pH为6.6的0.2M的PBS2.5mL,加入1%铁氰化钾溶液2.5mL,50℃反应后20min,加入10%TCA溶液2.5mL,4℃5000×g离心10min;吸取上清1ml,加入2.5mL蒸馏水和0.5mL1%FeCl3溶液,于700nm测定吸光度。以谷光甘肽为标准样品,绘制标准曲线回归方程为:y=0.9806x+0.0373(0.2mg/mL—1.2mg/mL,R2=0.9928)
式中:y为吸光度,x为谷光甘肽浓度。
DPPH自由基清除能力测定(DPPH)
①DPPH自由基清除率化学法
DPPH自由基清除率测定:吸取分子量5K以下的水牛奶干酪蛋白肽溶液200μL,加入1.8g/mL的DPPH乙醇溶液2mL,充分振摇后,室温下暗处反应20 min,于517nm处测定吸光值。DPPH自由基清除率采用如下公式计算:
DPPH·清除率(%)=[(s-sb)/(c-cb)]×100%
式中:s——DPPH·自由基清除能力吸光度,sb——样品干扰试验吸光度(调零),c——DPPH甲醇溶液吸光度,cb——蒸馏水吸光度(调零)。②DPPH薄层色谱-生物自显影技术.
根据徐亚萍等人的研究方法[18],称取DPPH 粉末96.70 mg,加甲醇溶解并稀释至刻度、摇匀,置于250 mL棕色量瓶中,将DPPH溶液均匀的喷洒在薄层色谱硅胶G(青岛海洋化工有限公司),从左到右依次为蒸馏水空白组、抗坏血酸标准组、实验组。
1.3.7.2抑菌活性测定
参照Tang Wenting等[15,19]方法测定抑菌率。取对数期细菌,以灭菌含有50 mol/mL的NaCl和pH7.4的PBS水洗3 遍后用新鲜Luria-Bertani培养基重悬为1×105 CFU/mL的菌悬液。将100 μL(5、10、15、20、25 mg/mL)GMP及P-GMP加入96 孔酶标板中,再加入等体积的菌悬液作为实验组;以100 μL含有NaCl的PBS代替等体积水牛奶乳蛋白肽为对照组。在37℃条件下培养12 h后,用酶标仪测定600nm波长处的OD值[20]。按如下公式计算酶解液的抑菌率:
抑菌率(%)=[(A对照组 - A实验组)/A对照组]×100%)
2结果与分析
2.1蛋白肽提取工艺
2.1.1单因素
(1)最优料液比的确定

图1-1料液比对多肽含量的影响
固定转速为11×1000rpm,匀浆时间为3min,考察料液比对肽得率的影响。由图2-1可以看出,随着料液比的变化肽得率出现先上升后下降的趋势,整体趋势明显。在料液比为25g/mL时肽得率最高。
(2)最优匀浆时间的确定
图1-2勺浆时间对多肽含量的影响
固定转速为11rpm×1000,料液比为1:25,考察匀浆时间对肽得率的影响。由图2-2可以看出,随着勺浆时间的变化肽得率出现明显的先上升后下降的趋势。在勺浆时间为6min时肽得率最高。
(3)最优匀浆转速的确定
图1-3 转速对多肽含量的影响
固定匀浆时间为6min,料液比为1:25,考察转速对肽得率的影响。由图1-3可以看出,随着转速的变化肽得率出现明显的波动趋势。当转速过低时,上清液中的肽分子无法被充分破碎出来,随着转速的增加,料液与转子之间的摩擦加大,料液受到的剪切力也增大,当转速过快时,料液与转子接触的时间减少,故肽得率降低。因此转速选择11 rpm×1000时最佳。
2.1.2数学模型的建立与检测
二次通用旋转试验方案及结果见表2。利用DPS软件对试验结果进行分析,得到二次回归模型为:
Y=0.53513+0.02875X1+0.01172X2+0.01618X1-0.04488X2^2-0.01663X1^2-0.02444X3^2-0.00093X1X2-0.01545X1X3+0.00422X2X3
表2 二次通用旋转试验方案及结果
试验号
X1
[液料比(mL/g)]
X2
(匀浆时间/min )
X3
(转速/rpm*1000 )
肽得率(mg/ml)
1
30
8
13
0.4550
2
30
8
9
0.5039
3
30
4
13
0.4639
4
30
4
9
0.4367
5
20
4
13
0.4876
6
20
8
9
0.3821
7
20
4
13
0.4002
8
20
4
9
0.4038
9
16.59
6
11
0.3574
10
33.4
6
11
0.4804
11
25
2.64
11
0.4881
12
25
9.36
11
0.5095
13
25
6
7.64
0.4348
25
6
14.36
0.5186
15
25
6
11
0.4743
16
25
6
11
0.5276
17
25
6
11
0.5676
18
25
6
11
0.5459
19
25
6
11
0.5313
20
25
6
11
0.5605
根据试验结果进行方差分析(见表3)。由表3可知,该回归模型达到显著水平(p<0.05),说明方程与实际情况拟合良好,能够反映肽得率提取效果与液料比、匀浆时间和匀浆转速的关系。
表3 回归方程方差分析表
变异来源
平方和
自由度
均方
偏相关
比值F
p-值
显著性
X1
0.0113
1
0.0113
0.6872
8.9492
0.0135
X2
0.0019
1
0.0019
0.3597
1.4857
0.2509
X3
0.0036
1
0.0036
0.4702
2.8383
0.1229
X1^2
0.029
1
0.029
-0.8349
23.0047
0.0007
X2^2
0.004
1
0.004
-0.4899
3.1578
0.1059
X3^2
0.0086
1
0.0086
-0.6369
6.8234
0.0259
X1X2
0
1
0
-0.0233
0.0054
0.9427
X1X3
0.0019
1
0.0019
-0.3626
1.5137
0.2467
X2X3
0.0001
1
0.0001
0.1033
0.1079
0.7493
回归
0.0552
9
0.0061
F2=4.86248
0.013
剩余
0.0126
10
0.0013
失拟
0.007
5
0.0014
F1=1.25941
0.3525
误差
0.0056
5
0.0011
总和
0.0678
19
2.1.3变量轮换直接寻优
根据已建立的数学模型,在-1.682≤Xi≤1.682(i=1,2,3)范围内,每个因素取5个水平(±1.682,±1,0),对53=125个方案进行统计寻优,在试验范围内可得肽得率的最高值为0.54,此时各因素取值为:X1=0,X2=-1.682,X3=0,对应着液料比25:1,匀浆时间2.64 min,匀浆转速11rpm*1000。
2.1.4频率分析及统计寻优
对不同设计水平下的组合进行模拟试验,以均值0.4765为临界值,获得大于临界值的方案50个,各变量取值的频率分布见表4。由表4可以看出,在95%的置信区间肽得率大于0.4765的优化方案为:料液比为26.61~28.40,匀浆时间为5.11~6.88,转速为10.42~11.58。为了贴近实际的工业化生产,可将优化方案定为:料液比为26:1,匀浆时间为5min,转速为10rpm*1000。
表4 优化提取方案中Xi取值频率分布表
因素水平
X1
[液料比(mL/g)]
X2
(匀浆时间/min)
X3
(转速/rpm*1000)
次数
频率
次数
频率
次数
频率
-1.682
0
0
6
0.2
0
0
-1
0
0
6
0.2
10
0.3333
0
15
0.5
6
0.2
10
0.3333
1
15
0.5
6
0.2
10
0.3333
1.682
0
0
6
0.2
0
0
加权均数
0.5
0
0
标准误
0.091
0.226
0.149
95%的置信区间
0.321...0.679
-0.443...0.443
-0.292...0.292
提取条件
26.61~28.40
5.11~6.88
10.42~11.58
2.2水牛奶干酪蛋白肽的功能活性
2.2.1抗氧化活性
(1)总抗氧化能力(TEAC)

图2-1 5K以下蛋白肽ABTS自由基清除率
由图2-1可知,随着水牛奶干酪蛋白肽浓度的提高,ABTS自由基清除活性均有增强。木瓜蛋白酶组的ABTS自由基清除活性最强,10 mg/mL时ABTS清除活性为85.63%;贯筋藤酶组的干酪蛋白肽浓度为10 mg/mL时ABTS清除活性为82.22%;来思尔组和对艾爱乳业组在蛋白肽浓度为10 mg/mL时ABTS清除活性为84.55%和83.79%。
(2)还原能力(RP)
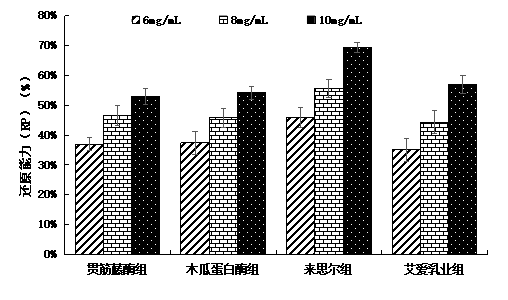

图2-2 5K以下蛋白肽还原能力
由图2-2可以看出,来思尔组的干酪蛋白肽还原能力明显高于其他实验组,其余三组之间差异不大。来思尔组在浓度为10mg/mL时还原能力为69.43%;贯筋藤酶组的干酪蛋白肽浓度为10 mg/mL时还原能力为52.96%。其差异或许与其生产工艺不同有关。
(3)自由基清除能力(DPPH)


图2-3 5K以下蛋白肽DPPH自由基清除率
由图2-3可以看出,来思尔组的干酪蛋白肽DPPH自由基清除活性稍高于其他实验组,其余三组组与组之间差距不大;来思尔组的干酪蛋白肽浓度在10mg/mL时其DPPH自由基清除能力达到62.64%,贯筋藤组相对较低,仅有52.63%的DPPH自由基清除能力。
(4)DPPH薄层色谱


图2-4 5K以下蛋白肽DPPH薄层色谱
从左到右依次为蒸馏水空白组、0.01mol/mL的抗坏血酸标准组、3mg/ml实验组,从上到下分别为 贯筋藤酶组、木瓜蛋白酶组、来思尔组、艾爱乳业组。从图2-4可以看出木瓜蛋白酶组的抗氧化活性最好,其后依次为来思尔组、艾爱乳业组、贯筋藤酶组。
2.2.2抑菌活性
(1)李斯特菌抑菌率
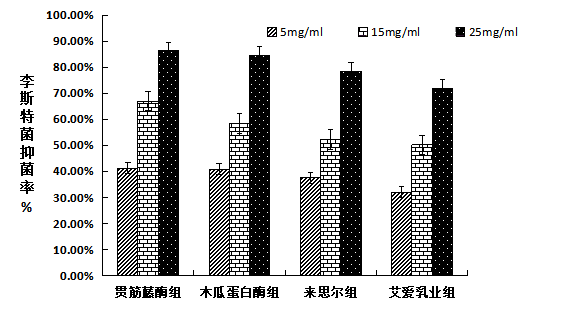

图3-1 李斯特菌抑菌率
由图3-1可知,各浓度的贯筋藤酶组蛋白肽均对代表革兰氏阳性菌的李斯特菌抑菌能力最强。在浓度为25mg/mL的浓度下,贯筋藤酶组的抑菌率高达86.33%,艾爱乳业组干酪的蛋白肽对李斯特菌的抑菌能力较弱。
(2)沙门氏菌抑菌率
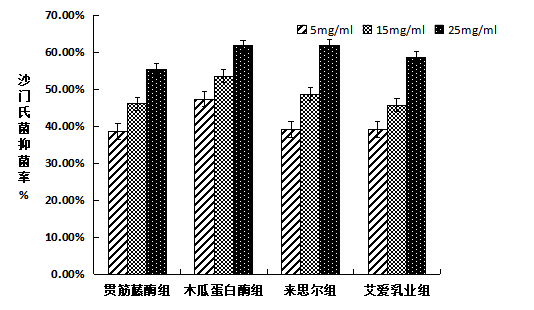

图3-2 沙门氏菌抑菌率
由图3-2可知,来思尔组与木瓜蛋白酶组对革兰氏阴性菌沙门氏菌的抑菌效果最好,在浓度为25mg/mL时抑菌率分别为61.87%和61.68%;贯筋藤组对沙门氏菌的抑菌能力相对较弱。四种干酪的不同浓度蛋白肽对李斯特菌、沙门氏菌均有抑制作用。
4 结论
经过单因素试验与二次通用旋转试验确定了料液比为26:1、匀浆时间为5min、转速10rpm*1000时为蛋白肽最佳提取工艺(蛋白肽提取率最高)。通过测定最佳提取条件下蛋白肽的抗氧化活性及抑菌作用,贯筋藤凝乳酶和木瓜蛋白酶加工得到的水牛奶奶酪中的蛋白肽具有较好的ABTS、DPPH自由基清除能力及铁离子还原能力;水牛奶干酪蛋白肽对李斯特菌、沙门氏菌均有良好的抑制作用。此研究表明水牛奶奶酪中富含功能活性肽,具有很大的开发价值。
参考文献
[1]梁明振, 杨炳壮, 苏安伟,等. 水牛奶营养价值评价[J]. 广西畜牧兽医, 2007, 23(3):124-126.
[2]赵立娜, 汪少芸, 黄一帆. 乳清蛋白生物活性肽及其应用前景[J]. 食品科学技术学报, 2014, 32(3):48-53.
[3]刘晶, 苗颖, 赵征. 乳清蛋白肽抗氧化活性的研究进展[J]. 中国乳品工业, 2011, 39(4):31-35.
[4]郑玮,付雪,钱方,牟光庆.酶法制备蛋清蛋白肽工艺条件研究[J].食品科技,2017,42(12):257-260.
[5]武志霞, 赵家明, 黄艾祥. 水牛奶研究开发进展[J]. 食品研究与开发, 2006, 27(3):139-141.
[6]王红燕, 陶亮, 陈森,等. 贯筋藤鲜茎中凝乳酶的提取工艺研究[J]. 中国酿造, 2015, 34(3):34-37.
[7]陶亮, 王红燕, 聂燕粉,等. 贯筋藤新型凝乳剂的研究[J]. 食品工业, 2015(11):88-92.
[8]黄艾祥, 马元元, 陶亮, et al. Dregea sinensis hemsl. var. corrugate plant milk coagulant: CN, CN 103271163 A[P]. 2013.
[9]陈新峰, 王君虹, 洪狄俊,等. 木瓜蛋白酶水解制备乳酪蛋白肽工艺条件的研究[J]. 浙江农业学报, 2008, 20(2):123-126.
[10]Sabeena Farvin KH, Andersen Lisa Lystbæk, Otte Jeanette, et al. Antioxidant Activity of (Gadus Morhua) Protein Hydrolysates: Fractionation and Characteris-ation of Peptide Fractions[J]. Food Chemistry, 2016, 204: 409-419.
[11]徐明芳,戴金凤,向明霞,成希飞,曾晓琮,万丛庆,周卫军.南方水牛奶酪蛋白及大豆蛋白肽指纹图谱的差异性[J].华南理工大学学报(自然科学版),2014,42(06):136-144.
[12]王红燕.贯筋藤蛋白酶对水牛奶Mozzarella干酪品质的影响[D].云南农业大学,2016.
[13]陈东平, 牟光庆. 不同分子量酪蛋白肽对自由基清除作用研究[J]. 中国酿造, 2010, 29(4):33-35.
[14]徐娟, 吕嘉枥. 乳蛋白水解液中多肽含量测定方法的研究[J]. 食品科技, 2010(12):275-278.
[15]Tang W, Zhang H, Wang L, et aL. AntimicrobiaL peptide isoLated from ovaLbumin hydroLysate by immobiLized Liposome-binding extraction[J]. European Food Research & TechnoLogy, 2013, 237(4):591-600.
[16]Zhu KX, Wang XP, Guo XN. Isolation and Characterization of Zinc-chelating Peptides from Wheat Germ Protein Hydrolysates[J]. Journal of Functional Foods,2015,12:23–32.
[17]童珊珊, 余江南, 徐希明,等. 薄层色谱-生物自显影技术测定绵茵陈提取液中绿原酸的含量并评价其抗氧化活性[J]. 中国药学杂志, 2009, 4 4(22):1738-1741.
[18]刘小玲, 林莹, 李全阳,等. 酶制剂对Mozzarella水牛奶酪品质影响[J]. 食品与机械, 2009, 25(1):21-24.
[19]黄佳琦, 杨士花, 初雅洁,等. 老黑谷米色素的提取工艺优化及体外抗氧化活性分析[J]. 食品科学, 2016, 37(2):19-24.
[20]Ahmad N, Sharma S, Alam MK, et al. Rapid Synthesis of Silver Nanoparticles Using Dried Medicinal Plant of Basil[J]. Colloids and Surfaces B-Biointerfaces,2012, 81(1): 81-86.
水牛奶干酪功能活性肽的研究
(上传时间:2019/4/12 18:55:18 文章来源:云南奶业协会信息中心 浏览次数 打印)收藏
电话:0871-3649220 传真:0871-3649220 E-mail:dayp2006@126.com 云南省奶业协会QQ群:51121847 技术支持:昆明网站建设,云南网站建设-四度网络



 您当前位置:
您当前位置: